Белки - это высокомолекулярные азотсодержащие вещества, состоящие из аминокислот, связанных между собой пептидными связями. Белки иначе называют протеинами; этот термин введен в 1838 г. и образован от греч. слова proteos - первостепенный.
Белки составляют значительную часть тканей живого организма: до 25% сырой и до 45 - 50% сухой массы. Они содержат 50- 59% углерода, 6,5 - 7,3% водорода, 15 - 18% азота, 21 - 24% кислорода, до 2,5% серы. Для большинства белков характерна довольно постоянная доля азота (в среднем 16% от сухой массы) по сравнению с другими элементами. Этот показатель используют для расчета количественного содержания белка. Для этого массу азота, найденную при анализе, умножают на коэффициент 6,25 (100 : 16 = 6,25).
В составе некоторых белков обнаруживают фосфор, железо, цинк, медь и другие элементы.
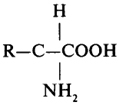
Структурными блоками или мономерами белков служат α-аминокислоты L-ряда (см. табл. 4). Общая формула α-аминокислот имеет следующий вид:
14
Выделенное звено формулы α-аминокислоты является неизменным для всех протеиногенных аминокислот, его можно назвать аминокислотным блоком. Аминокислоты различаются по структуре бокового радикала (R), а следовательно, и по физико-химическим свойствам, присущим этим радикалам.
Таблица 4
Протеиногенные аминокислоты
| Формула |
Название |
Сокращенное обозначение |
| H2N - CH2 - COOH |
Глицин |
гли |
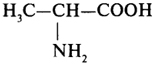 |
Алании |
ала |
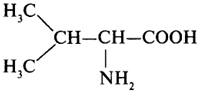 |
Валин |
вал |
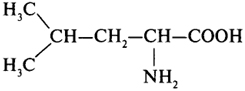 |
Лейцин |
лей |
 |
Изолейцин |
иле |
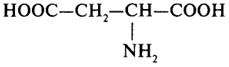 |
Аспарагиновая кислота |
асп |
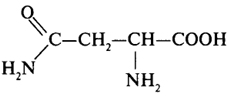 |
Аспарагин |
асн |
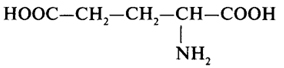 |
Глутаминовая кислота |
глу |
 |
Глутамин |
глн |
15
Продолжение табл. 4
| Формула |
Название |
Сокращенное обозначение |
 |
Серии |
сер |
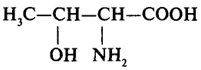 |
Треонин |
тре |
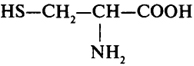 |
Цистеин |
цис |
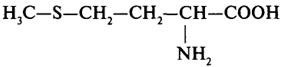 |
Метионин |
мет |
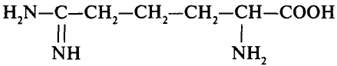 |
Аргинин |
арг |
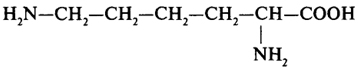 |
Лизин |
лиз |
 |
Гистидин |
гис |
 |
Пролин |
про |
 |
Фенил ал анин |
фен |
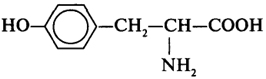 |
Тирозин |
тир |
16
Окончание табл. 4
| Формула |
Название |
Сокращенное обозначение |
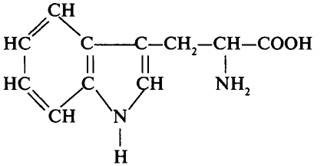 |
Триптофан |
три |
В таблице 4 представлены аминокислоты, постоянно встречающиеся в белках. В некоторых белках встречаются редкие аминокислоты (оксипролин, γ-карбоксиглутаминовая кислота, гидроксилизин, 3,5-дийодтирозин и др.), которые являются производными тех же 20 протеиногенных аминокислот.
Аминокислоты относятся к амфотерным электролитам: недиссоциированная форма аминокислоты в нейтральном водном растворе превращается в диполярную форму (цвиттерион), которая способна взаимодействовать как с кислотами, так и с основаниями. Рассмотрим амфотерность аминокислот на примере аланина.

Взаимодействие диполярного иона с кислотой можно выразить следующей схемой:
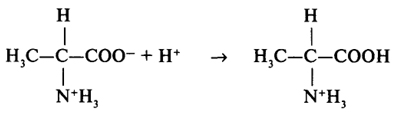
Превращение диполярного иона в щелочной среде:

17
По кислотно-основным свойствам аминокислоты делят в зависимости от физико-химических свойств бокового радикала на три группы: кислые, основные и нейтральные.
К кислым относятся аминокислоты с карбоксильными группами в боковом радикале: аспарагиновая и глутаминовая кислоты. К основным относятся аминокислоты лизин, аргинин и гистидин, имеющие в боковом радикале группировку с основными свойствами: аминогруппу, гуанидиновую и имидазольную группы. Все остальные аминокислоты - нейтральные, так как их боковой радикал не проявляет ни кислых, ни основных свойств.
Следовательно, аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд, зависящий от рН-среды. Значение рН-среды, при котором заряд аминокислоты равен нулю, называется изоэлектрической точкой. Изоэлектрическая точка отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. К ним относятся глицин, аланин, серин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей. Для организма человека такими аминокислотами являются тирозин, аргинин, гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому они должны поступать с пищей. Незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Аминокислотный состав белков определяется не доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его биологической функцией. В настоящее время определен аминокислотный состав многих сотен белков.
18
