Атомы водорода, снятые с субстратов в цикле Кребса, в результате β-окисления ВЖК, а также пируватдегидрогеназной, глутаматдегидрогеназной и некоторых других реакций, поступают в дыхательную цепь ферментов (рис. 23), которая иначе называется электронотранспортной цепью.
Процесс переноса протонов и электронов (атом водорода = протон водорода (Н+) + электрон (e) ) начинается с передачи атомов водорода с восстановленной формы НАД или ФАД.
146

Рис. 23. Схема электронотранспортной цепи
Восстановленный НАД отдает водороды на флавопротеин, ко-ферментом которого является ФМН, а восстановленный ФАД всегда передает водороды на кофермент Q. После кофермента Q по системе цитохромов осуществляется транспорт только электронов; роль конечного - терминального - акцептора электронов выполняет кислород. Перед тем как подробнее изучить работу электронотранспортной цепи, познакомимся с химическим строением отдельных ее компонентов.
Как отмечалось ранее, все компоненты электронотранспортной цепи являются ферментами, катализирующими окислительно-восстановительные процессы.
Флавопротеин является первым ферментом, акцептирующим протоны и электроны от первичной дегидрогеназы - фермента, снимающего атомы водорода непосредственно с субстрата. Кофер-ментом флавопротеина является ФМН. Со структурой и окислительно-восстановительными реакциями ФМН мы познакомились ранее (см. главу 4). Этот фермент тесно связан с железосерными белками.
Железосерные белки имеют небольшую молекулярную массу (порядка 10 кДа). Они содержат негеминовое железо, связанное с атомами серы остатков цистеина. На рис. 24 представлен лишь один из возможных вариантов комплекса атома железа с атомами серы, существующих в белках, содержащих негеминовое железо.
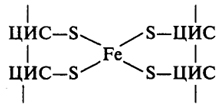
Рис. 24. Схема образования комплекса атома железа с атомами серы в железосерных белках
147
Эти белки участвуют в переносе протонов и электронов и, как предполагают, на нескольких стадиях. Однако до сих пор не ясен механизм, по которому железосерные белки претерпевают обратимое окисление-восстановление.
Кофермент Q или убихинон растворен в липидной части внутренней мембраны митохондрий. Убихинон может диффундировать как поперек, так и вдоль мембраны. Он является единственным, не связанным с белками компонентом цепи дыхания; по этой причине его нельзя отнести к ферментам. Кофермент Q принимает два протона водорода и два электрона от железосерных белков, превращаясь в гидрохинон:

Восстановленный кофермент Q далее "выбрасывает" протоны водорода в матрикс, а по цепи дыхания транспортируются только электроны. Транспорт электронов осуществляют цитохромы.
Цитохромы представляют собой гемопротеины. В настоящее время известно около 30 различных цитохромов. Все они, в зависимости от своей способности поглощать свет, разделяются на классы, обозначаемые строчными буквами - а, b, с и т.д. Внутри каждого класса выделяют отдельные виды цитохромов, обозначая их цифровыми индексами - b, b1, b2 и т.д.
Цитохромы отличаются друг от друга структурой тема, структурой полипептидной цепи и способом прикрепления тема к ней. На рисунке 25 показана структура тема, входящего в состав всех цитохромов b.
Цитохромы окрашены в красно-коричневый цвет; окраска обусловлена наличием катиона металла. Цитохромы классов b и с содержат в своем составе катионы железа, а цитохромы класса а - катионы меди.
148
Цитохромы а и a3 образуют комплекс, который называют цито-хромоксидазой. Уникальная особенность комплекса а·а3 заключается в том, что эта система цитохромов передает электроны непосредственно на кислород.
Перенос электронов по цепи цитохромов включает обратимые реакции:
Fe3+ + e ————→ ←———— Fe2+ и Сu2+ + e ————→ ←———— Сu+
Познакомившись с характеристикой компонентов электронотранспортной цепи и с окислительно-восстановительными реакциями, протекающими в ней, перейдем к рассмотрению процесса, который является основным при аккумуляции энергии в форме АТФ.
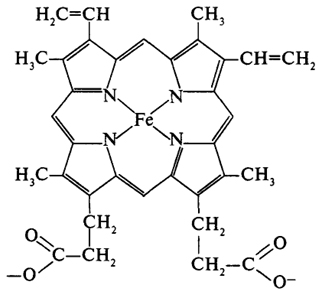
Рис. 25. Структура тема цитохрома
b
Механизм сопряжения дыхания с фосфорилированием АДФ. Транспорт протонов и электронов от восстановленного НАД к молекулярному кислороду представляет собой экзергонический процесс:
НАДН + Н+ + ½О2 → НАД+ + Н2О + энергия
Если еще упростить запись этого процесса, то получим уравнение реакции горения водорода в кислороде, которое известно всем со школьной скамьи:
Н2 + ½О2 → Н2О + энергия
Разница состоит лишь в том, что при реакции горения энергия освобождается сразу полностью, а в цепи дыхания, благодаря тому
149
что она разбита на несколько окислительно-восстановительных реакций, происходит поэтапное освобождение энергии. Эта энергия аккумулируется в фосфатных связях АТФ и используется для жизнедеятельности клеток.
Первым результатом работы электронотранспортной цепи является образование эндогенной воды, в молекуле которой атомы водорода являются водородами, снятыми с субстратов соответствующими дегидрогеназами, а атом кислорода - терминальным акцептором электронов (см. рис. 23). Приняв на себя 2 электрона, он превращается в реакционноспособный анион (О2-), который сразу же взаимодействует с протонами водорода, "выброшенными" коферментом Q. Образование эндогенной воды происходит в матриксе митохондрий.
Механизм сопряжения дыхания с фосфорилированием АДФ был разработан английским биохимиком П. Митчеллом, гипотеза которого получила название протондвижущей или хемиосмотической. В нашей стране гипотеза П. Митчелла была развита в работах В.П. Скулачева.
Согласно хемиосмотической гипотезе энергия переноса протонов и электронов вдоль дыхательной цепи первоначально сосредоточивается в виде протонного потенциала, создающегося движением через мембрану заряженных протонов водорода. Транспорт протонов обратно через мембрану сопряжен с фосфорилированием АДФ, которое осуществляется протонзависимой АТФсинтазой (Н+ = АТФаза).
Поскольку движущей силой синтеза АТФ является протонный потенциал, подробнее рассмотрим его образование.
Наряду с переносом протонов и электронов по цепи дыхания осуществляется дополнительный выброс протонов водорода из матрикса в межмембранное пространство. Протоны водорода возникают при диссоциации воды в матриксе:
Н2O —→ ←— H+ + OH-
Перенос протонов водорода через внутреннюю мембрану митохондрий, как предполагают, осуществляется протонными транслоказами. В результате такого переноса мембрана со стороны матрикса заряжается отрицательно (за счет оставшихся отрицательно заряженных гидроксилов), а со стороны межмембранного пространства - положительно (за счет перекачки положительно заряженных протонов водорода). В результате такого распределения зарядов возникает электрический потенциал, обозначаемый
150
Δψ (дельта пси). А за счет возникшей разницы в концентрации протонов водорода по обе стороны внутренней мембраны митохондрий создается химический градиент протонов, обозначаемый АрН. Оба возникших потенциала создают на мембране электрохимический трансмембранный градиент протонов (ΔμН+), следовательно ΔμН+ = Δψ + ΔрН
Синтез АТФ. Мембрана, на которой создается электрохимический трансмембранный градиент протонов называется энергизированной. Энергизированная мембрана стремится разрядиться за счет перекачки протонов из межмембранного пространства обратно в матрикс (рис. 26). Этот процесс осуществляется с помощью про-тонзависимой АТФазы.
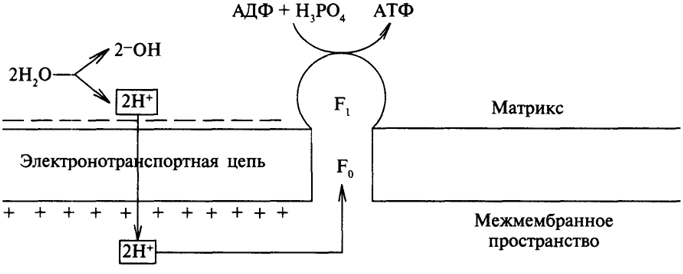
Рис. 26. Синтез АТФ, сопряженный с электронотранспортной цепью
Н+-АТФаза встроена во внутреннюю мембрану митохондрий. Она похожа на гриб и состоит из двух белковых факторов F0 и F1 (рис. 27). Фактор F0 пронизывает всю толщу внутренней мембраны митохондрий. Шаровидная часть, выступающая в матрикс митохондрий, - это фактор F1. Строение, свойства и функции этих белковых факторов совершенно разные.
Фактор F0 состоит из трех гидрофобных полипептидных цепей разной структуры. Этот фактор выполняет функцию протонпроводящего канала, по которому протоны водорода попадают к фактору F1.
Фактор F1 является водорастворимой частью Н+-АТФазы и представляет собой белковый комплекс, состоящий из девяти субъединиц пяти разных типов. Одна эпимолекула фактора F1 содержит 3 α, 3β и по одной субъединице γ, δ, ε (α3β3γδε). Фактор F1 осуществляет синтез АТФ из АДФ и фосфорной кислоты. Центры связывания АДФ и АТФ находятся в субъединицах α и β каждая
151
из которых может удерживать по одной молекуле АДФ или АТФ. Согласно данным рентгеноструктурного анализа центры связывания АДФ и АТФ находятся на стыке субъединиц α и β. Субъединица β выполняет каталитическую функцию в синтезе АТФ (рис. 27).
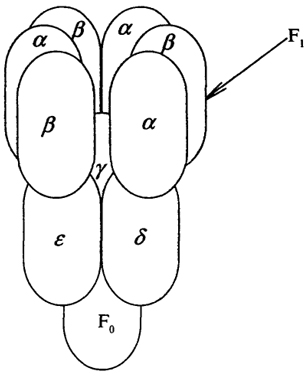
Рис. 27. Строение протонзависимой АТФазы
Существует несколько концепций, объясняющих механизм образования АТФ при посредстве Н+-АТФазы. Все концепции рассматривают протоны водорода, поступающие по протонпрово-дящему каналу к фактору F1, в качестве активаторов различных процессов, приводящих к образованию АТФ из АДФ и фосфорной кислоты.
Как только атомы водорода или электроны достигают определенного компонента цепи дыхания, из матрикса в межмембранное пространство выбрасывается 2 протона водорода, и на внутренней мембране митохондрий возникает ΔμН+; протоны проходят через протонпроводящий канал и достигают фактора F1 H+-АТФазы, которая катализирует синтез АТФ. Если в цепь дыхания атомы водорода поставляет НАД, то возникают 3 точки сопряжения работы цепи дыхания с синтезом АТФ, т.е. происходит синтез 3 молекул АТФ. Если в цепь дыхания атомы водорода поставляет ФАД, то синтезируются 2 молекулы АТФ.
В мышечной клетке существует митохондриальный ретикулум, при помощи которого митохондрии связаны в единую цепь или представляют собой одну гигантскую разветвленную митохондрию.
152
По ее энергизированной мембране ΔμН+ может передаваться на большие расстояния, обеспечивая в нужном месте синтез необходимого количества АТФ для совершения мышечной работы.
153
