Реакции энергетического обмена представляют важнейшую функцию микроорганизмов, связанную с их преимущественно химическим взаимодействием со средой. Это взаимодействие полностью определяется термодинамическими закономерностями. Бактерии удивительно полно используют возможности получения энергии, но в этом отношении действует ряд ограничений, обусловленных способами ее превращения.
Источниками энергии для организмов могут служить свет и восстановленные химические соединения. Способность использовать энергию света свойственна фотосинтезирующим микроорганизмам, представляющим несколько филогенетически и функционально различных групп. Наибольшее распространение получил оксигенный фотосинтез, осуществляемый цианобактериями и всеми фототрофными эукариотами. Для природоведческой микробиологии его значение связано прежде всего с первичной продукцией, представляющей исходный этап большинства трофических цепей, и с образованием молекулярного кислорода, обеспечивающего существование аэробов.
Способность использовать химическую энергию присуща всем без исключения организмам. Особенно многообразны возможности прокариот. Это относится как к природе окисляемых субстратов, которыми могут быть неорганические (например, Н2, S2-, S0, S2О3-2, NH3, Fe2+, CO) или многочисленные органические соединения, так и окислителей (О2 Fe3+, NO3-, SO42, S0, CO2, органические вещества). Организмы используют в первую очередь субстраты, дающие наибольший выигрыш энергии.
Возможность использовать энергию химической реакции для роста организмов определяется изменением свободной энергии, AG (т.е. той энергией, которая при постоянном давлении и температуре может быть превращена в работу). Понятие свободной
27
энергии является одним из центральных понятий термодинамики, оно достаточно подробно обсуждается в руководствах по физической химии. Применительно к биологическим системам можно рекомендовать соответствующие главы "Биохимии" А. Ленинджера (1970).
Изменение свободной энергии в реакции
A+B=C+D
может быть вычислено через константу равновесия реакции как:
Δ
G = Δ
G° + 2,ЗОЗ
RT lg
К = Δ
G + 2,303 lg

,
где R - газовая постоянная;
Т - абсолютная температура в градусах Кальвина;
К - константа равновесия реакции;
[А], [В], [С], [D] - концентрации субстратов (А, В) и продуктов (С, D) реакции;
ΔG° - стандартное изменение свободной энергии, рассчитанное для стандартных условий реакции: давлении 1 атм и 1 М концентрации всех реагирующих веществ;
ΔG° = 2,303RT lg К, и эта величина является постоянной характеристикой реакции. Для обозначения стандартной свободной энергии при рН 7, что соответствует физиологическим условиям, используют символ ΔG°.
Важнейшим следствием приведенного уравнения является зависимость роста микроорганизмов от удаления продуктов реакции, что достигается их взаимодействием с микроорганизмами, потребляющими эти продукты. Другим вариантом служит удаление продуктов в виде газов или образование нерастворимых минералов. Эти закономерности применимы не только к одной реакции, но и к цепочке реакций, осуществляемых сообществом.
Изменение стандартной свободной энергии может быть также определено как разность между свободной энергией исходных веществ и свободной энергией продуктов реакции при стандартных условиях. Значения свободной энергии ряда соединений, часто используемых в метаболизме микроорганизмов, приведены В табл. 1.
28
Таблица 1
Свободные энергии образования важнейших соединений1
1 кал = 4,184 Дж
| Соединение |
Свободная энергия
образования,
кДж/моль |
Соединение |
Свободная энергия
образования,
кДж/моль |
| СО |
-137,34 |
Формиат |
-351,54 |
| СО2 |
-394,95 |
Ацетат |
368,93 |
| СH4 |
-50,82 |
Алании |
-372,07 |
| Н2CO3 |
-624,05 |
Аспартат |
-699,73 |
| НСО3- |
-587,69 |
Бутират |
-353,21 |
| СО32- |
-528,65 |
Валериат |
-344,34 |
| Н2 |
0 |
Глицерин |
-490,23 |
| Н+ при рН0 |
-5,69 на ед. рН |
Глутамат |
-699,73 |
| Н2О |
-237,57 |
Глюкоза |
-917,61 |
| Н2O2 |
-134,28 |
Капроат |
-335,96 |
| О2 |
0 |
Лактат |
-519,56 |
| ОН при рН14 |
-157,54 |
Малат |
-846,38 |
| ОН при рН7 |
-198,76 |
Метанол |
-157,56 |
| ОН при рН10 |
-237,57 |
Пропионат |
-361,08 |
| N2 |
0 |
Пируват |
-473,47 |
| NO |
+86,73 |
Сукцинат |
-691,35 |
| NO2 |
+51,95 |
Формальдегид |
-130,72 |
| N20 |
104,33 |
Цитрат |
-1169,01 |
| NO2- |
-37,29 |
Этанол |
-181,84 |
| NO3- |
-111,45 |
|
|
| NH4+ |
-79,61 |
Свободная энергия гидролиза
переносчиков энергии |
| PO4+ |
1026,55 |
|
|
| S0 |
0 |
|
|
| SO32- |
-486,04 |
Фосфоенол-пируват (ФЕП) |
-62,0 |
| SO42- |
-745,82 |
|
|
| S2O32- |
-511,18 |
1, 3 бисфосфо-глицерат |
-52,0 |
| H2S |
-27,23 |
|
|
| HS- |
+12,06 |
Ацетил-фосфат |
-43,1 |
| S2- |
+85,89 |
АТФ в АДФ |
-31,8 |
| Fe2+ |
-85,05 |
АТФ в ПФ
(пирофосфат) и АМФ |
-41,7 |
| Fe3+ |
-10,47 |
|
|
| FeS2 |
-150,84 |
|
|
| FeSO4 |
-829,62 |
ПФ |
-21,9 |
| Mn2+ |
-227,93 |
АДФ |
-30,6 |
| MnO2 |
-456,71 |
АМФ |
-14,2 |
29
Связь стандартной свободной энергии реакции с окислительно-восстановительным потенциалом выражается уравнением:
ΔG°' = nF ΔE0',
где п - число перенесенных протонов;
F - число Фарадея;
ΔE0' - разность стандартных окислительно-восстановительных потенциалов (E0') акцептора и донора электронов (табл. 2). В условиях контакта с атмосферой веществом, задающим окислительно-восстановительный потенциал, в первую очередь, является О2.
Таблица 2
Окислительно-восстановительные потенциалы
некоторых веществ, участвующих в энергетическом
метаболизме микроорганизмов1
| Окислительно-восстановительная пара |
Е0, В |
Окислительно-восстановительная пара |
Е0, В |
| S042- / HSO3- |
-0,52 |
Фумарат / сукцинат |
+0,33 |
| СО2 формиат |
-0,43 |
Цитохром в ок. / восст. |
+0,035 |
| 2Н+ / Н2 |
-0,41 |
Убихинон ок. / восст. |
+0,113 |
| S2O32- / HS- + HSO3 |
-0,40 |
Диметилсульфоксид / диметилсульфид |
+0,16 |
| Ферредоксин ок. / восст. |
-0,39 |
|
|
| Флаводоксин ок. / восст. |
-0,37 |
Fe(OH)3 + НСОЗ / FеСОЗ |
+0,20 |
| НАД / НАДН |
-0,32 |
S3O62- / S2O2- + HSO32- |
+0,225 |
| Цитохром с, ок. / восст. |
-0,29 |
Цитохром с, ок. / восст. |
+0,23 |
| СО2 / ацетат |
-0,29 |
NO2- / NO |
+0,36 |
| S0 / HS- |
-0,27 |
Цитохром сц ок. / восст. |
+0,385 |
| CO2 / CH4 |
-0,24 |
NO3- / NO2- |
+0,43 |
| SO42- / HS- |
-0,217 |
Se042- / SeO32- |
+0,475 |
| Ацетальдегид / этанол |
-0,197 |
Fe3+ / Fe2+ |
+0,77 |
| Пируват / лактат |
-0,19 |
Mn4+ / Mn2+ |
+0,798 |
| Флаводоксин ок. / восст. |
-0,12 |
O2 / H20 |
+0,82 |
| SO32- / HS- |
-0,116 |
NO / N2O |
+ 1,18 |
| Менахинон ок. / восст. |
-0,075 |
N2O / N2 |
+1,36 |
30
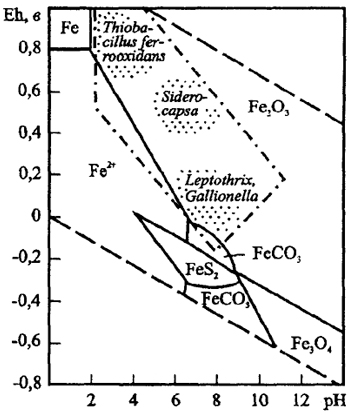
Рис.3. Поля устойчивости соединений железа в координатах Eh-pH
Показаны области развития основных групп железобактерий. Пунктир - поле устойчивости воды
Для природоведческой микробиологии важнейшим показателем служит окислительно-восстановительное состояние среды обитания микроорганизмов. Для реакций неорганических веществ были рассчитаны поля устойчивости соединений и минералов в координатах окислительно-восстановительного потенциала Eh и рН (диаграммы Пурбэ). Eh характеризует восстановленность среды, а рН отражает концентрацию протонов. В качестве примера на рис. 3 приведена диаграмма устойчивости соединений железа. Микроорганизмы развиваются в поле
устойчивости продукта реакции и неустойчивости (метастабилъности) субстрата. Поэтому геохимические поля устойчивости минералов и области развития микроорганизмов и их сообществ коррелируют между собой, что принципиально важно для геохимии.
31
1
Выборка из Thauer R., Jungerman К., Decker К. // Bacteriol. Rev., 1977. Vol. 41. P. 100-180.
1
no Thauer R., Jungcrman K., Decker K. 1977.
