Между удельной скоростью роста dx/x dt, обозначаемой |μ, и концентрацией субстрата существует гиперболическая зависимость (рис. 24), установленная Ж. Моно и описываемая уравнением, получившим его имя:
где μ, - удельная скорость роста;
μmах - максимальная возможная скорость роста, не ограниченная концентрацией субстрата;
Кs - константа, соответствующая концентрации субстрата, при которой достигается 1/2 максимальной скорости роста; s - концентрация субстрата в среде.
Величина μmax зависит от природы организма, и соответственно организмы разделяются на быстро и медленно растущих. Величина Кs характеризует сродство организма к субстрату и определяет его способность расти при низких концентрациях субстрата,
78

Рис. 24. Зависимость скорости роста μ и урожая
х от начальной концентрации субстрата (по Г. Шлегелю, 1987)
S
0 - минимальный порог концентрации субстрата
разделяя виды организмов по эффективности их транспортных систем. Для глюкозы обычно величина Кs не превышает 10 мг/л.
От констант μmах и Кs зависит конкурентоспособность организмов, использующих один и тот же субстрат, по "правилу скрещивающихся кривых": при низкой концентрации субстрата выигрывает организм с высоким сродством к субстрату и малой Кs при высокой концентрации - организм с высокой μmax- Соответственно они обозначаются как олищгрофы и копиотрофы. На самом деле в одном и том же сосуде или местообитании растут оба организма, только одного нарастает больше. Важное значение имеет минимальная концентрация субстрата, при которой транспортные системы организма уже не эффективны. Эта величина часто определяет остаточную концентрацию субстрата в природе по достижении микроорганизмами максимальной плотности. Например, пороговые концентрации Н2 в среде существенно различаются для разных групп анаэробных гидрогенотрофных организмов. Наименьшее сродство к водороду у гомоацетатных организмов - около 1000 ppm (partes pro million, 10-6 по объему) в газовой фазе, за ними следуют метаногены с порогом 5-100 ppm; у сульфатредукторов эта величина менее 1 ppm, а у бактерий, восстанавливающих железо, еще ниже. Поскольку концентрация продукта реакции
79
влияет на ее термодинамический выход, то рост образующих водород анаэробов зависит от того, какой конечный уровень Н2 устанавливается в среде.
В конкуренции не менее важное значение, чем скорость роста, имеет выживание, в том числе и при минимальной концентрации субстрата: выигрывает не только тот организм, численность которого больше в данный момент, но и тот, у которого скорость отмирания меньше. Отмирание в необычной среде ведет к процессу самоочищения природных сред, и типичным примером служит отмирание индикаторных фекальных организмов Е. coli, например, в море. Отмирание или его противоположность - выживание, очень сильно варьирует у разных видов, обусловливая их приспособительные реакции. Обычно считается, что удельная скорость отмирания постоянна. Однако гораздо более часто приходится сталкиваться с гетерогенностью популяции по этому свойству, когда клетки, находящиеся в разном физиологическом состоянии, отмирают с существенно разной скоростью.
Кроме описанного здесь роста с использованием резервуара вещества при его колонизации - ситуации стандартной в лабораторных условиях, - следует рассмотреть еще два варианта.
Первый случай представляет хемостат - проточный бассейн, в котором происходит полное смешение. В таком бассейне прирост прямо пропорционален скорости притока субстрата и выноса продуктов. Для всех организмов здесь существует одинаковая вероятность выноса из реактора и правило скрещивающихся кривых реализуется в полной мере. В бассейне устанавливаются стационарные концентрации субстрата, продукта и активной биомассы (рис. 25). Примером хемостата в природе может служить рубец жвачных, но не всякий пищеварительный тракт, аналогичный трубчатому реактору, по которому пищевой комок перемещается, как пробка. Вообще в природе условия хемостата, удобного для изучения экспоненциального роста в лаборатории, реализуются далеко не так часто. Однако применение хемостата для изучения роста популяций бактерий и простые закономерности, связывающие потребление субстрата, скорость роста, плотность популяции, позволили на этой основе разработать обширную теорию роста микробных популяций, где особенно удобно изучать
80
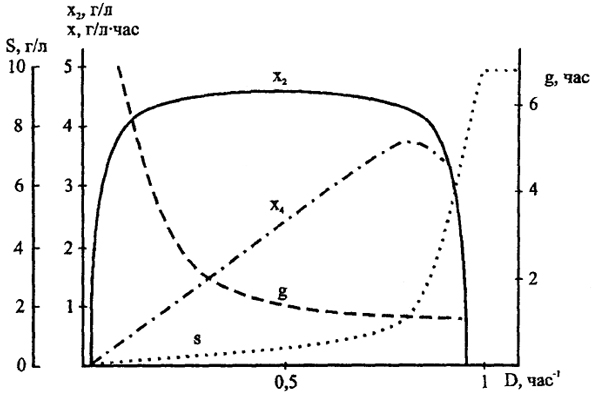
Рис. 25. Хемостатная кривая (по М. Madigan et al, 1997)
Соотношение между плотностью бактериальной суспензии (х
2), концентрацией субстрата (s), временем удвоения бактерий (g) и урожаем биомассы (х) в хемостате. D - скорость разбавления
действие лимитирующих факторов на чистых культурах и конкурентные отношения на смешанных.
Второй случай - это так называемое приточное культивирование, когда рост ограничен притекающим извне субстратом, а вынос отсутствует. Превышение потенциальной скорости роста над скоростью поступления субстрата приводит к тому, что достигается полное использование субстрата и максимальная плотность, как при малых скоростях притока в хемостате. Рост пропорционален притоку субстрата и оказывается линейным. Например, для аэробов рост ограничивается поступлением кислорода из воздуха в воду, в которой растворимость О2 составляет, в зависимости от температуры, около 0,25 ммоль/л. Транспорт О2 ограничен поверхностью контакта жидкости с воздухом и, следовательно, рост становится линейным. Для аэробов лимитирующей часто оказывается концентрация кислорода менее 0,1 мг/л. По этой концентрации организмы разделяются на аэробов и микроаэрофилов. Отсутствие выноса биомассы приводит к возрастающему потреблению на поддержание, и рост затухает. В условиях хемостата приточному культивированию соответствуют условия, когда
81
приток субстрата и вынос клеток меньше скорости роста: при этом достигается высокая плотность биомассы, а концентрация субстрата низкая. Ситуация приточного культивирования очень распространена в природе для всех закрепленных на твердом субстрате - иммобилизованных - клеток в биопленках. Многие организмы имеют специальные приспособления для закрепления на твердой фазе. Наилучшим примером сопротивления выносу могут служить обитатели быстро текучих вод - кренофилы. Они образуют развевающиеся в турбулентном потоке космы цепочек клеток, объединенных в нити трубчатым влагалищем, как, например, Sphaerotilus или Crenothrix. В более широком плане следует считать нерегулярный приточный режим наиболее характерным для природных условий. Нерегулярность условий приводит к тому, что даже организмы с коротким жизненным циклом, как бактерии, большую часть жизни находятся в переходном состоянии.
Для большинства условий можно упростить характер экспоненциального роста микробной популяции, описывая его двумя пересекающимися прямыми: 1) до начала резкого возрастания численности; 2) до достижения максимальной плотности. Отсутствие выноса приводит к развитию в виде микроколоний. Дальнейшее накопление массы клеток обусловливает блокирование их от поступления субстрата, и часть клеток переходит в покоящееся состояние, а часть отмирает. Разумно предположить, что в стабильных условиях численность клеток находится в состоянии линейного роста при плотности близкой к максимальной. Однако в природе условия нестабильны, и поэтому микробы находятся в переходном состоянии от одного режима к другому, которые отличаются пороговыми переходами. Особо следует отметить важность численности готовых к размножению клеток - величина, учитываемая микробиологами при высеве на среды.
При экстраполяции этой лабораторной модели культивирования микроорганизмов в искусственных питательных средах на природные условия нужно сделать поправки на физиологическое состояние клеток, транспорт веществ в окружающей клетки среде, взаимодействие с другими-организмами в сообществе. В каждом участке среды происходит рост организмов, их отмирание, привнес в исследуемый объем и вынос из него.
82
