Превращение информации в активный белок фермента происходит в рибосоме и представляет центральный момент экспрессии гена. Рибосомы состоят из двух субъединиц, образующих довольно крупные структуры, по форме напоминающие цифру "8". Рибосомы митохондрий и хлоропластов оказались сходными с рибосомами соответственно бактерий и цианобактерий, что послужило основным аргументом в пользу гипотезы образования эукариотной клетки, как химеры в результате эндосимбиоза. Рибосомы, расположенные в цитоплазме эукариотической клетки, и рибосомы прокариот различаются. Различия между ними представлены ниже (S - так называемый коэффициент седиментациии, характеризующий скорость осаждения в центрифуге):
Свойства рибосом
Прокариоты
Эукариоты
(в цитоплазме)
- Общие размеры
- Малая субъединица
- размер РНК
- (число нуклеотидов)
-
-
- Большая субъединица
- размер РНК
- (число нуклеотидов)
- 70S
- 30S
- 5S
- (120)
- 16S
- (1500)
- 50S
- 23S
- (3000)
- 80S
- 40S
- 5S
- (120)
- 18S
- (2000)
- 60S
- 28S
- (5000)
Выделенная жирным шрифтом 16S рРНК и соответствующий ей ген 16S рДНК послужили базой для современной филогенетической классификации бактерий на основе установления последовательностей нуклеотидов. Очень полная картина степени сходства
54
рибосом послужила для построения универсального филогенетического дерева жизни. Вполне ли отражает она эволюцию организмов, геном которых может быть образован комбинаторно, - отдельный вопрос, который обычно стараются не обсуждать.
Передача информации, закодированной в мРНК, к рибосоме и аминокислотам осуществляется с помощью тРНК, изображения которой напоминают клеверный лист или карточный знак "треф". На "ножке" находится акцептор аминокислоты, а на противоположном конце петля антикодона, распознающая кодон на мРНК. Одна боковая петля (T) предназначена для связывания с рибосомой, а другая петля (D) - для связывания с ферментом (аминоацил-тРНК синтетазой).
Реакция начинается активацией аминокислоты под действием аминоацил-тРНК синтетазы с последующим присоединением активированной аминокислоты к тРНК:
аминокислота + АТФ = аминоацил-АМФ + пирофосфат
аминоацил-АМФ + тРНК = аминоацил-тРНК + АМФ
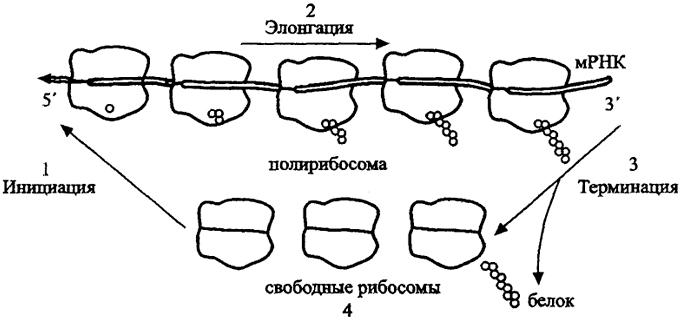
Рис.17. Трансляция (по А.С.Спирину, 1999)
1. Свободная рибосома соединяется с мРНК у начала кодирующей последовательности на инициирующем кодоне
(инициация). 2. Считывание кодирующей последовательности по триплетам нуклеотидов в направлении от 3' к 5' концу мРНК с последовательным присоединением по одной аминокислоте
(элонгация). 3. Дойдя до стоп-кодона, рибосома прекращает трансляцию и освобождает полипептид
(терминация). 4. Свободные рибосомы готовы вступить в новый цикл. После инициации рибосома продвигается по мРНК к 5' концу и освобождает инициирующий кодон, к которому может присоединиться следующая рибосома и т.д. В результате образуется полирибосома - комплекс рибосом, синтезирующих один и тот же белок с одной молекулы мРНК.
55
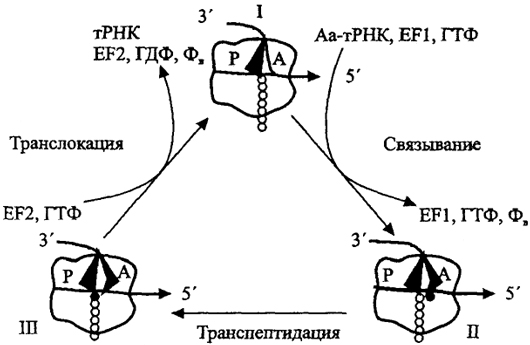
Рис.18. Элементарный элонгационный цикл - считывание одного триплетного кодона мРНК и образование одной пептидной связи (по А.С.Спирину, 1999)
Рибосома "сидит" на мРНК, удерживая молекулу пептидил-тРНК (I). Когда пеп-тидил-тРНК занимает Р-участок малой субъединицы, рибосома может связывать молекулу аминоацил-тРНК (Аа-тРНК), соответствующую кодону, находящемуся в А-участке. В результате бок о бок оказываются последняя аминокислота синтезируемого пептида и новая аминоацил-аминокислота с тРНК (II). Трансферазный центр на большой субъединице катализирует реакцию образования пептидной связи. В Р-участке остаются деацилированная тРНК, а в А-участке - тРНК с удлиненной пептидной цепью (III). После этого деацилированная тРНК выталкивается из рибосомы, а пептидил-тРНК перемещается в Р-участок. В результате в А-участке устанавливается следующий кодом мРНК. Связывание аминоацип-тРНК катализируется фактором элонгации EF-1 с участием ГТФ, а транслокация - фактором элонгации EF-2 с ГТФ. Каждый шаг элонгации требует затраты ГТФ. Основная роль ГТФ - каталитическая, а не термодинамическая.
Синтез белка на рибосоме включает этапы: инициацию, элонгацию и терминацию (рис. 17). Свободные 30S и 50S субъединицы рибосом объединяются с мРНК и тРНК в инициирующий комплекс при участии белков-факторов инициации.
Синтез белка начинается со стартового кодона с формилмети-онин-тРНК. Далее происходит присоединение аминоацил-тРНК и движение рибосомы по нити мРНК с образованием пептидной связи между последовательно присоединяющимися аминокислотами- элонгация (рис. 18, 19).
Малая субъединица имеет два участка связывания: А-участок - аминоацил-тРНК-связывающий (для поступающих аминокислот); Р-участок - аминоацилпептидил-тРНК-связывающий (для синтезируемой полипептидной цепочки). Свободный А-участок имеет
56

Рис. 19. Расположение функциональных центров на субчастицах рибосомы (по А. С. Спирину, 1999)
Цепь мРНК связана с малой субчастицей между участками Р и А. Две молекулы тРНК на Р- и А-участках связаны своими антикодонами со смежными кодонами мРНК. Пептидилтрансферазный центр РТС и факторы элонгации EF располагаются на большой субчастице.
кодон мРНК, соответствующий мРНК следующей по порядку аминокислоте, и связывается с амино-ацил-тРНК, имеющей соответствующий антикодон. Далее происходит реакция пептидил-тРНК и аминсацил-тРНК, расположенных рядом на рибосоме. Следующий шаг приводит к разъединению тРНК и выбрасыванию ее из рибосомы, а удлиненная на одну аминокислоту пептидил-тРНК перемещается на одну позицию относительно мРНК под действием большой субъединицы.
По мере выхода из рибосомы полипептидная цепочка сворачивается, приобретая структуру, необходимую для проявления ферментативной активности. Наконец
завершается синтез по достижении стоп-кодона стадией терминации - отделения цепочки от рибосомы. Весь процесс можно осуществить in vitro (бесклеточный синтез белка), но система очень сложная.
Благодаря различиям в строении рибосом эубактерии, архебактерии и эукариоты обнаруживают разную чувствительность к антибиотикам - ингибиторам синтеза белка. Это позволяет, в частности, применять антибиотики, действующие на эубактерии, для селективного накопления архебактерий.
Рассмотренные механизмы синтеза белка универсальны для всех живых существ. Ознакомившись с ними, полезно ответить себе на вопрос, действительно ли "жизнь - это ДНК"?
Для целей природоведческой микробиологии, которая начинает построение свой логики с целого организма, а не его частей, наибольший интерес представляют не универсальные процессы, а те этапы, которые ответственны за формирование функциональных различий как между организмами, так и разными состояниями одного организма. Последнее тесно связано с адаптацией. Она обусловлена экспрессией или репрессией генов, т.е. синтезом или же прекращением синтеза ферментативных белков.
57
