Потенциалы Доннана, или мембранные потенциалы, устанавливаются, когда в контакте находятся две фазы (например, раствор электролита и мембрана), содержащие несколько различных ионов. При этом один из ионов способен проходить через границу раздела фаз, а для другого такой переход затруднен. Затруднения перехода могут иметь механическую природу - для полупроницаемых мембран, либо химическую - для ионообменных. Избирательная проницаемость межфазной границы возникает в случае, когда какие-либо ионы достаточно прочно связаны в одной из фаз и поэтому покинуть ее вообще не могут. Именно так ведут себя в ионообменных смолах ионогенные группы, закрепленные гомеополярными связями в молекулярной решетке (матрице). Ионогенные группы не могут покинуть матрицу. Раствор, находящийся внутри такой матрицы, образует вместе с ней одну фазу, раствор, находящийся вне ее, - вторую. Растворенные ионы со временем распределяются между фазами равновесно. Непрерывный обмен ионами через границу раздела является характерным свойством ионитов [43]. На рис. 2.9 показана схема катионита. Молекулярная решетка, обозначенная линиями, несет ионогенные группы (1). Противоионы (2) могут свободно перемещаться в электролите, заполняющем матрицу, и могут обмениваться на другие положительные ионы.
На рис. 2.10 поясняется возникновение разности потенциалов между двумя фазами, разделенными полупроницаемой перегородкой (диафрагмой). Пусть обе фазы 1 и 2 содержат одинаковые катионы К+ и анионы А-, способные проникать через границу. Фаза 1 содержит также закрепленные ионы R-.
63
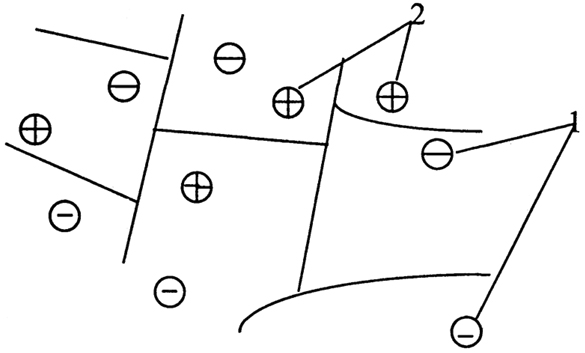
Рис. 2.9. Схема матрицы катионообменной:
1- ионогенные группы;
2 - противоионы

Рис. 2.10. Схема возникновения доннанова потенциала на полупроницаемой Диафрагме
По условию электронейтральности в каждой фазе суммарная эквивалентная концентрация катионов должна быть равна концентрации анионов
[K+]1,=[A-]1+[R-]1,
[К+]2=[А-]2.
Отсюда следует, что в первой фазе концентрация подвижных катионов должна отличаться от концентрации группы R- и [K+]1 > [A-]1. Это условие может выполняться при равновесии только в случае, когда [K+]1 > [К+]2 и [A-]1 < [А-]2. Вследствие разности концентраций между фазами устанавливается разность потенциалов. Условием равновесности концентраций [K+]1 и [A-]1 является равенство нулю результирующих потоков обоих компонентов через границу одновременно при одном и том же потенциале. Такое возможно при одном равновесном соотношении концентраций, которое определяется равновесием Доннана и которому соответствует равновесный доннанов потенциал. Если принять, что нормальный
64
химический потенциал каждого из веществ в обеих фазах одинаков, то можно получить уравнение равновесия Доннана
aK(1)·aA(1) = aK(2)·aA(2)
(2.72)
где ак,А - активность катиона и аниона в фазах 1 и 2.
Потенциал Доннана определяется по уравнению
| ED = φ(1) - φ(2) = |
RT |
ln |
aK(2) |
= |
RT |
ln |
aA(2) |
| F |
aK(1) |
F |
aA(1) |
(2.73)
Если фаза 2 (раствор) содержит несколько катионов или анионов различной валентности, то равновесное распределение каждого из ионов между фазами будет определяться равенством электрохимических потенциалов для каждого из ионов в обеих фазах
η(1) = μj(1) + Zj·F·φ = ηj(2) = μj(2) + Zj·Fφ(2)
(2.74)
где η - электрохимический потенциал;
φ - химический потенциал ;
Z - заряд иона.
Доннанов потенциал для каждого из Zj катионов* удовлетворяет условию
| ED = φ(1) - φ(2) = |
1 |
(μj(2) - μj(1))= |
RT |
ln |
aj(2) |
| Zj·F |
ZjF |
aj(1) |
(2.75)
В случае, когда имеются ионы двух разновидностей т и n, тогда из выражения (2.75) можно получить
| ( |
am(1) |
)Zn |
=( |
an(1) |
)Zm |
| am(2) |
an(2) |
| или |
CmnZ(1)·CnmZ(2) |
=K |
| CmnZ(2)·CnmZ(1) |
(2.76)
Если знак заряда ионов т и п одинаков и противоположен знаку заряда иогенных групп в ионите ZR , тогда равновесная концентрация этих ионов в ионите становится больше, чем в растворе
| Cm(1) |
>1u |
Cn(1) |
>1 |
| Cm(2) |
Cn(2) |
а при К = 1:
| Cm(1) |
=( |
Cn(1) |
)Zm/Zn |
| Cm(2) |
Cn(2) |
Из выражения (2.77) следует, что ионит сильнее поглощает противоионы с большей величиной заряда. Особенно сильная селективность поглощения многозарядных ионов происходит, когда общая концентрация
65
раствора (фаза 2) мала по сравнению с концентрацией закрепленных ионов в ионите.
Рассмотрим пример обессоливания воды (раствор NaCl, pH = 7) с помощью Н-катионита и ОН-анионита. В обессоливаемом растворе (фаза 2) отношение СNa+/СH+ и, следовательно, aNa+/aH+ очень велико. Катионит будет поглощать из раствора ионы натрия, меняя их на свои подвижные противоионы водорода, пока в нем не установится такое же соотношение. При поддержании концентрации NaCl на постоянном уровне все ионы Н+ катионита обменяются на ионы Na+.
Аналогичный процесс происходит в ОН-анионите, обменивающем свои противоионы ОН- на ионы Сl- из фазы 2.
Таким образом получают воду, свободную от ионов и обладающую низкой электропроводностью. Предел обессоливания определяется условием равновесия:
| aNa+ |
= |
aNa+(R) |
или |
≈ |
CNa+ |
= |
CNa+(R) |
| aH+ |
aH+(R) |
CH+ |
CH+(R) |
(2.78)
Индекс "R" обозначает активность или концентрацию соответствующего иона в ионите. Если оба ионита использовать наполовину их емкости, то CNa+(R)//CH+(R) = 1 и CCl-(R)/OHH-(R) = 1. Тогда по условию электронейтральности при равновесии CNa+/CH+ = 1 и CCl-/OHH- = 1 При рН = 7 такой момент соответствует концентрации NaCl в обессоленной воде ≈ 10-7моль/л.
Рассмотренные выше доннановы потенциалы возникают на пористых полупроницаемых перегородках. Ионообменные мембраны ведут себя иначе. Полный мембранный потенциал ЕM, складывается из двух разновидностей потенциалов (рис. 2.11).
66
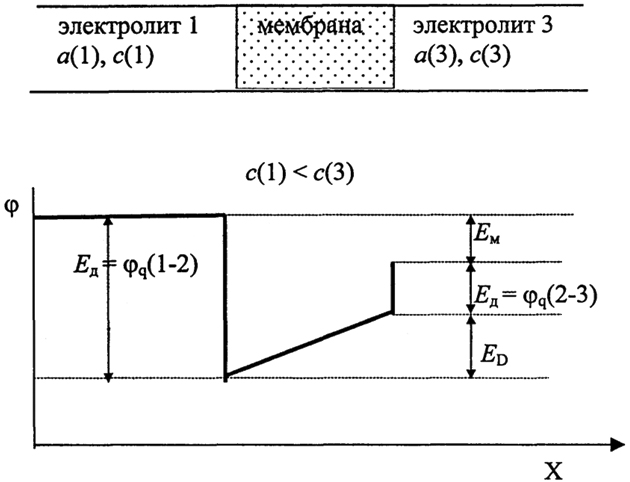
Рис.2.11. Изменение потенциала в катионообменной мембране
При установлении равновесия каждой стороны мембраны со смачивающим ее раствором возникают две разности потенциалов: φ(1-2) и φ(2-3). При условии С1 ≠ С3 различными будут и концентрации в поверхностных слоях мембраны, непосредственно прилегающих к электролитам. В результате возникающий внутри мембраны градиент концентрации, вызывает появление некоторой диффузии и соответствующего диффузного потенциала. Тогда
EM= φa(1-2) + ED + φa(2-3).
(2.91)
В случае, когда концентрация ионообменных групп ׀ZR׀ · CR >> C1 и С3 электролита, то и суммарный заряд подвижных противоионов в мембране по условиям данного равновесия практически равен суммарному заряду ионообменных групп С(2) ≈ ׀ZR׀ · CR. Тогда концентрация в ионите коиона, имеющего одинаковый знак с ионнообменными группами, приближенно выражается уравнением С’(2) ≈ C2/|ZR|·CR, где С- концентрация во внешнем растворе. Величина С’(2) в этом случае очень мала, но и перепад концентрации основных противоионов в мембране согласно условию электронейтральнсти тоже мал. Поэтому диффузионный потенциал имеет очень малые значения и им можно пренебречь. В этом случае уравнение мембранного потенциала имеет вид
67
(2.80)
Знак "+" соответствует аниониту, "-" катиониту.
В другом случае, когда |ZR|·CR<<C1 и Сз, мембранный потенциал определяется следующим образом:
| EM= |
RT |
· |
ZRCR |
( |
γ±(2-3) |
- |
γ±(1-2) |
) + ED |
| F |
2 |
a(3) |
a(1) |
(2.81)
где γ±- коэффициент активности на границе фаз.
По мере увеличения внешней концентрации первое слагаемое в этом уравнении стремится к нулю, и, в конечном итоге, мембранный потенциал переходит в диффузионный.
68
