Окислительно-восстановительные процессы, протекающие на электродах под действием электрического тока, называются электролизом. Для протекания процесса электролиза необходимо иметь раствор электролита, погруженные в него электроды, внешний источник тока и металлический проводник, соединяющий электроды с источником тока. Электрод, принимающий электроны от участников реакций, т.е. на котором происходит процесс окисления, называется анодом. Электрод, отдающий электроны участникам реакции, - катод. На катоде происходит процесс восстановления (рис 2.4).
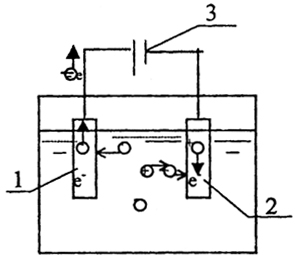
Рис.2.4. Схема процесса электролиза:
1 - анод, 2 - катод,
3 - источник тока
Находящиеся в растворе отрицательные ионы - анионы - притягиваются к положительному электроду - аноду, а положительные ионы - катионы - притягиваются к отрицательному электроду - катоду. Анионы отдают аноду свои электроны, превращаясь в нейтральные атомы. Катионы забирают у катода избыточные электроны, также превращаясь в нейтральные атомы. При этом число электронов, получаемых анодом, равно числу электронов, передаваемых за то же время катодом. На границе раздела электрод-раствор происходит переход от электронной проводимости к ионной, причем прохождение электрического тока через проводники второго рода (растворы электролитов) сопровождается выделением на электродах продуктов электрохимической реакций [102,103].
Между количеством прореагировавшего на электродах вещества и количеством прошедшего через электролит электричества существует зависимость, определяемая законами Фарадея.
43
При прохождении электрического тока через любую электрохимическую систему возникает прямо пропорциональная зависимость между количеством прошедшего электричества и количеством прореагировавших на электродах веществ:
Δm=kэ·q=kэ·I·t,
(2.25)
где Δm - количество прореагировавшего вещества; k - коэффициент пропорциональности; q - количество электричества, равное произведению величины тока I на время t.
Если величину тока выразить в амперах, время - в часах, то
I · t = I Ач, тогда Δm = kэ - электрохимический эквивалент, представляет собой количество вещества в граммах, которое выделяется на электроде при прохождении единицы количества электричества. Выражение (2.25) называется первым законом Фарадея.
По второму закону, при прохождении через различные электролиты одного и того же количества электричества, количества выделившихся на электроде веществ пропорциональны их химическим эквивалентам:
kэ= Э/F,
(2.26)
где F- число Фарадея, равное 96500 Кл.
Подставив (2.26) в (2.25), можно получить объединенный закон: • для выделения одного грамм-эквивалента любого вещества необходимо затратить одно и то же количество электричества
Δm= Эmt/F.
(2.27)
Законы Фарадея принадлежат к числу наиболее общих и точных законов электрохимии. Однако на практике часто встречаются отклонения от законов Фарадея, связанные с образованием меньшего количества вещества, чем рассчитанное теоретически. Это связано с протеканием на электродах побочных электрохимических реакций, на которые затрачивается часть количества электричества. Для учета влияния побочных электрохимических реакций используют понятие выхода по току, η - это отношение количества продукта, фактически образовавшегося при электролизе, к количеству, рассчитанному по закону Фарадея:
Итак, при прохождении электрического тока через раствор электролита на электродах происходят электрохимические реакции окисления и восстановления. На катоде может происходить восстановление ионов водорода с выделением газообразного водорода или выделение металла из раствора его соли и др. На аноде протекают реакции окисления, например, разряд гидроксильных ионов с образованием газообразного кислорода, растворение
44
металла и др. Протекание реакции на одном электроде невозможно без протекания сопряженной с ней реакцией на другом электроде. Скорость электрохимической реакции зависит от материала электрода, состава и температуры электролита, адсорбции на электроде каких-либо компонентов из раствора и других факторов. Зависимость скорости электродной реакции от условий ее протекания, механизм электродной реакции являются объектом изучения раздела кинетики электродных процессов.
45
