Движение ионов в растворах может происходить не только под влиянием электрического поля, но и вследствие разности концентрации (диффузии) [41,42]. Скорость диффузии, согласно закону Фика, для идеального раствора определяется как
(2.16)
где dm - количество растворенного вещества, перенесенное за время dτ через сечение q;
D - коэффициент диффузии, см2/с.
Коэффициент диффузии для катионов и анионов можно определить по следующей зависимости:
| Dк,а= |
νк,аRT |
= |
uк,aRТ |
| zк,аF |
zк,аF2 |
(2.17)
Для одновалентного электролита
| Dэл-та= |
2νк,a·νaRT |
| (νк + νa)zF |
(2.18)
При практических расчетах коэффициента диффузии i-го сорта ионов Di можно использовать формулу
(2.19)
35
Некоторые значения коэффициентов диффузии ионов для бесконечно разбавленных растворов при 25 °С приведены в табл. 2.3
Подставив (2.17) в уравнение (2.16) можно получить выражения скорости диффузии катионов ωK и анионов а:
| ωк=- |
RTνк |
· |
1 |
· |
dCк |
, |
| zkF |
Ck |
dx |
| |
|
|
|
| ωa=- |
RTνa |
· |
1 |
· |
dCa |
. |
| zaF |
Ca |
dx |
(2.18)
Таблица 2.3
Коэффициенты диффузии ионов для бесконечно разбавленных растворов при 25°С
| Ион |
DK×10-5, см2·с-1 |
Ион |
Da×10-5, см2·с-1 |
| Н+ |
9,34 |
Zn2+ |
0,72 |
| Li+ |
1,04 |
Cr6+ |
0,80 |
| Na+ |
1,35 |
ОН- |
5,23 |
| К+ |
1,98 |
Cl- |
2,03 |
| Рb2+ |
0,98 |
SO42- |
1,08 |
| Сu2+ |
0,72 |
СrO42- |
1,07 |
| Ni2+ |
0,69 |
|
|
В общем случае подвижности катионов и анионов неодинаковы, а, следовательно, не равны их коэффициенты диффузии Dk ≠ Da. Поэтому при одном и том же градиенте концентрации dC/dx скорость диффузии катионов и анионов различна. Рассмотрим диффузию на примере раствора NaCl. Из таблицы 2.3 следует, что DCl> DNa. Если взять растворы концентраций С1 и С2, разделенные пористой перегородкой (рис. 2.3), то в начальный момент анионы будут перемещаться быстрее, чем катионы. В результате этого возникает разность потенциалов между концентрированными и разбавленными растворами, которая будет тормозить движение ионов Cl- и ускорять движение Na+. При дальнейшем росте потенциала скорости движения ионов станут равными VK = Va, диффузия электролита будет происходить подобно диффузии недиссоциированных молекул.
36
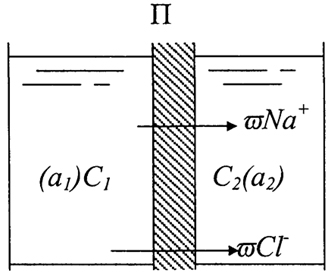
Рис. 2.3. Схема возникновения диффузионного потенциала в растворе NaCl
концентрацией C
1 > С
2
Возникающая внутри раствора стационарная разность потенциалов, вызванная различной подвижностью ионов называется диффузионным потенциалом, φд. Его значение между растворами I и II в общем виде определяется как
| φд =- |
RT |
∫III |
∑ |
ti |
d ln ai |
, |
| F |
zi |
(2.19)
где ai - активность отдельного иона;
ti - число переноса этого иона;
zi - заряд иона;
или через коэффициент диффузии и концентрацию:
| φд= |
Da - Dk |
· |
RT |
ln |
C2 |
. |
| zкDк + |za|Da |
F |
C1 |
(2.20)
Для рассмотренного примера (рис. 2.3) при выбранных условиях DC1 > D>Na и С1 > С 2 величина φд < 0. В случае равенства коэффициентов диффузии катионов и анионов Da = Dk диффузионный потенциал φд=0
37
