Применение электрохимических методов обработки водных сред основано на их электролизе, сущность которого заключается в проведении химических реакций окисления и восстановления за счет использования электрической энергии. Процесс электролиза протекает в растворах (или расплавах), которые обладают преимущественно ионной проводимостью -электролитах.
Важнейшими представителями растворов электролитов являются водные растворы солей, кислот и оснований (щелочей), т.е. наиболее распространенных неорганических и многих органических соединений. Природные и сточные воды многих предприятий являются растворами электролитов, т.к. в них всегда присутствуют ионы в той или иной концентрации [35].
При изучении свойств растворов электролитов было установлено, что их осмотическое давление, понижение давления пара, повышение температуры кипения и понижение температуры замерзания имеют большие величины по сравнению с величинами, которые характеризуют растворы неэлектролитов той же концентрации. Наблюдаемые явления были объяснены на основе теории электролитической диссоциации (Аррениус, 1883 г.). Согласно этой теории, молекулы электролитов, в отличие от молекул неэлектролитов, при растворении в соответствующем растворителе распадаются на заряженные частицы - ионы, например,
NaCl ←→ Na++Cl-.
Следует иметь в виду, что переход ионов в раствор сопровождается их гидратацией (сольватацией):
NaCl + nH2 ←→ Na+(Н2О)Х+Сl-(Н2О)n-Х.
Диссоциация молекул на ионы приводит к увеличению общего числа частиц, что оказывает определенное влияние на свойства растворов. Поэтому законы Вант-Гоффа и Рауля становятся применимы для растворов электролитов лишь при введении изотонического коэффициента i:
28
| pосм = i · |
m |
RT, |
|
Δp |
= i · |
n |
. |
| M |
p0 |
n + N |
(2.1)
Количественной характеристикой электролитической диссоциации является степень диссоциации электролита в растворе - отношение числа молекул n, распавшихся на ионы, к общему числу растворенных молекул п0:
α = n/n0
(2.2)
Очевидно, что степень диссоциации может изменяться от нуля (диссоциации нет) до 1 (полная диссоциация):
0≤α≤1.
По степени диссоциации растворы электролитов делят на сильные и слабые. Однако зависит от природы растворенного вещества и растворителя, а также от концентрации раствора. Если рассматривать электролитическую диссоциацию как равновесный химический процесс, то в соответствии с принципом Ле-Шателье добавление растворителя, как правило, увеличивает количество продиссоциированных молекул, что приводит к увеличению (рис. 2.1).
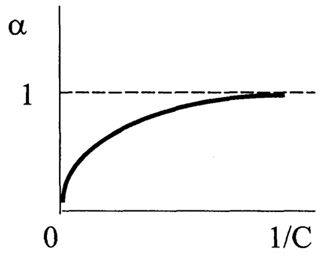
Рис.2.1. Зависимость степени диссоциации от разбавления раствора 1/С
Процесс электролитической диссоциации удобнее характеризовать, как и любой другой равновесный процесс, константой химического равновесия, которую в этом случае называют константой диссоциации. Например, для реакции
АВ ←→ А+ + В-
29
константа диссоциации К по закону действующих масс равна
(2.3)
где [А+], [В-], [АВ] - молярные концентрации компонентов.
В отличие от α, К зависит только от температуры и природы реагирующих веществ.
Между К и α существует количественная зависимость. Если молекула диссоциирует на два иона А+ и В-, концентрация вещества АВ равна С, а степень диссоциации - α, тогда [А+] = [В-] = αС, и
(2.4)
где (1-α) - количество непродиссоциировавших молекул вещества.
Данное выражение называется законом разведения Оствальда. В случае слабых электролитов α <<1 , тогда
K=α2C и α=√
(2.5)
где 1/С - разбавление раствора.
Для сильных электролитов (α>0,3) степень диссоциации не отражает истинного количества молекул электролита, распавшихся на ионы. Опытным путем определяется так называемая кажущаяся степень диссоциации, которая всегда меньше истинной степени диссоциации. Для учета суммарного влияния ряда факторов, в частности ассоциации сольватированных ионов, используется понятие активности, или эффективной концентрации. Активность а связана с истинной концентрацией С соотношением
a = f·C,
(2.6)
где f- коэффициент активности, характеризует степень отклонения свойств данного раствора от идеального.
30
